Laboratuvarda yeni biri olarak, dönüşüm oranı düşük bir bitki demetinden pozitif bitkileri elemek iyi bir iş değildir.Öncelikle çok sayıda örnekten tek tek DNA ekstraksiyonu yapılmalı ve daha sonra PCR ile yabancı genler tespit edilmelidir.Bununla birlikte, sonuçlar genellikle boşluklar ve ara sıra birkaç öğe içeren bantlardır, ancak gözden kaçan algılamaların mı yoksa yanlış algılamaların mı olduğunu belirlemek imkansızdır..Böyle deneysel süreç ve sonuçlarla yüzleşmek çok mu çaresiz?Endişelenmeyin, kardeşim size transgenik pozitif bitkileri nasıl kolay ve doğru bir şekilde eleyeceğinizi öğretiyor.
Aşama 1
Tasarım algılama primerleri
Test edilecek örneğe göre tespit edilecek endojen geni ve eksojen geni belirleyin ve primer tasarımı için gende temsili bir 100-500bp dizisi seçin.İyi primerler, tespit sonuçlarının doğruluğunu sağlayabilir ve tespit süresini kısaltabilir (yaygın olarak kullanılan tespit primerleri için eke bakın).
Uyarı: Yeni tasarlanan primerlerin, reaksiyon koşullarını optimize etmesi ve büyük ölçekli algılamadan önce algılamanın doğruluğunu, kesinliğini ve saptama limitini doğrulaması gerekir.
Adım 2
Deney protokolü tasarla
Pozitif kontrol: PCR reaksiyon sisteminin ve koşullarının normal olup olmadığını belirlemek için hedef fragmanı içeren saflaştırılmış DNA'yı şablon olarak kullanın.
Negatif/boş kontrol: PCR sisteminde bir kontaminasyon kaynağı olup olmadığını saptamak için şablon olarak hedef fragmanı içermeyen DNA şablonunu veya ddH2O'yu kullanın.
Dahili referans kontrolü: Şablonun PCR ile tespit edilip edilemeyeceğini değerlendirmek için test edilecek numunenin endojen geninin primer/prob kombinasyonunu kullanın.
Fark etme:
Deneysel sonuçların geçerliliğini değerlendirmek için her test için pozitif, negatif/boş kontroller ve dahili kontrol kontrolleri ayarlanmalıdır.
deney hazırlığı
Kullanmadan önce, çözeltinin eşit şekilde karışıp karışmadığını gözlemleyin.Çökelti bulunursa, kullanımdan önce talimatlara göre çözülmeli ve karıştırılmalıdır.Düzensiz iyon dağılımını önlemek için kullanımdan önce 2×PCR karışımının pipetlenmesi ve bir mikropipet ile tekrar tekrar karıştırılması gerekir.
Fark etme:
Kılavuzu çıkarın ve dikkatlice okuyun ve kılavuzun gerekliliklerine tam olarak uygun olarak deney öncesi hazırlıkları yapın.
Adım 4
PCR reaksiyon sistemini hazırlayın
Deney protokolüne göre primerleri, H2O ve 2×PCR karışımını eşit şekilde karıştırın, santrifüjleyin ve bunları her bir reaksiyon tüpüne dağıtın.
Fark etme:
Büyük ölçekli veya uzun süreli testler için, PCR ürünlerinin neden olduğu aerosol kontaminasyonunu etkili bir şekilde önleyebilen UNG enzimi içeren bir PCR reaksiyon sisteminin kullanılması önerilir.
Adım 5
Tepki şablonu ekle
Direct PCR teknolojisi kullanılarak, zahmetli nükleik asit saflaştırma işlemine gerek kalmaz, numune şablonu 10 dakika içinde hazırlanabilir ve ilgili PCR reaksiyon sistemi eklenebilir.
Fark etme:
Bölünme yöntemi daha iyi tespit etkisine sahiptir ve elde edilen ürün çoklu tespit reaksiyonları için kullanılabilir.
5.1: Yaprakların doğrudan genişlemesi
Kılavuzdaki resmin boyutuna göre yaprak dokusunu 2-3mm çapında kesin ve PCR reaksiyon sistemine yerleştirin.
Not: Yaprak parçalarının tamamen PCR reaksiyon solüsyonuna batırıldığından emin olun ve aşırı yaprak dokusu eklemeyin.
5.2: Yaprak ayırma yöntemi
Yaprak dokusunu 5-7 mm çapında kesin ve bir santrifüj tüpüne yerleştirin.Olgun yaprakları seçerseniz, lütfen yaprağın ana damarının dokularını kullanmaktan kaçının.50ul Tampon P1 lizatı bir santrifüj tüpüne pipetleyerek lizatın yaprak dokusunu tamamen batırmasını sağlayın, bir termal döngüleyiciye veya metal bir banyoya yerleştirin ve 95°C'de 5-10 dakika parçalayın.
50ul Tampon P2 nötralizasyon solüsyonu ekleyin ve iyice karıştırın.Nihai lizat, bir şablon olarak kullanılabilir ve PCR reaksiyon sistemine eklenebilir.
Not: Şablon miktarı, PCR sisteminin %5-10'u arasındadır ve %20'yi geçmemelidir (örneğin, 20μl PCR sisteminde, 4μl'den fazla olmamak kaydıyla 1-2μl lizis solüsyonu ekleyin).
Adım 6
PCR reaksiyonu
PCR reaksiyon tüpü santrifüjlendikten sonra amplifikasyon için bir PCR cihazına yerleştirilir.
Fark etme:
Reaksiyon, amplifikasyon için saflaştırılmamış şablon kullanır, dolayısıyla amplifikasyon döngülerinin sayısı, saflaştırılmış DNA şablonu kullanıldığında olduğundan 5-10 döngü daha fazladır.
Adım 7
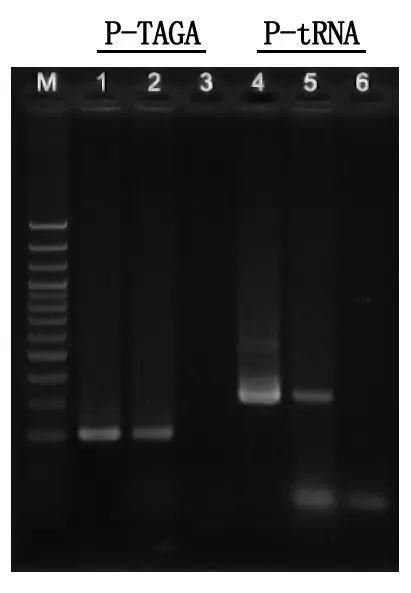
Elektroforez tespiti ve sonuç analizi
M: 100bp DNA Merdiveni
1\4: Saflaştırılmış DNA yöntemi
2\5: Doğrudan PCR yöntemi
3\6: Boş kontrol
KK:
Deneyde ayarlanan çeşitli kontrollerin test sonuçları aşağıdaki koşulları karşılamalıdır.Aksi halde sorunun kaynağı araştırılmalı, sorun giderildikten sonra tekrar test yapılmalıdır.
Tablo 1. Çeşitli kontrol gruplarının normal test sonuçları
*Plazmid pozitif kontrol olarak kullanıldığında, endojen gen testi sonucu negatif olabilir
Sonuç yargısı:
A. Numunenin endojen geninin test sonucunun negatif olması, normal PCR tespitine uygun DNA'nın numuneden ekstrakte edilemeyeceğini veya ekstrakte edilen DNA'nın PCR reaksiyon inhibitörleri içerdiğini ve DNA'nın tekrar ekstrakte edilmesi gerektiğini gösterir.
B. Numunenin endojen geninin test sonucunun pozitif olması ve eksojen genin test sonucunun negatif olması, normal PCR tespiti için uygun DNA'nın numuneden ekstrakte edildiğini ve XXX geninin numunede tespit edilmediği yargısına varılabileceğini gösterir.
C. Numunenin endojen geninin test sonucunun pozitif olması ve eksojen genin test sonucunun pozitif olması, normal PCR tespiti için uygun DNA'nın numuneden çıkarıldığını ve numune DNA'sının XXX genini içerdiğini gösterir.Doğrulama deneyleri ayrıca gerçekleştirilebilir.
Adım 8
Tasarım algılama primerleri
Deneyden sonra, çevre kirliliğini önlemek için deney alanını silmek için %2 sodyum hipoklorit solüsyonu ve %70 etanol solüsyonu kullanın。
Gönderim zamanı: Eylül-08-2021